Onderzoek met gekweekte plakjes hartweefsel: nieuw mechanisme achter hartregeneratie in zebravissen ontdekt
Hart- en vaatziekten, zoals hartaanvallen, zijn wereldwijd een belangrijke doodsoorzaak doordat het hart een beperkte capaciteit heeft zichzelf te herstellen. Anders dan mensen kunnen zebravissen hun hart wel herstellen na schade. Onderzoekers uit de groep van Jeroen Bakkers (Hubrecht Instituut/UMC Utrecht) hebben zebravissen gebruikt om hun regeneratieve succes te verklaren. Ze ontdekten een nieuw mechanisme dat werkt als een schakelaar om hartspiercellen te rijpen tijdens regeneratie. Dit mechanisme had een zeer vergelijkbaar effect op hartspiercellen van muizen en mensen en is dus evolutionair geconserveerd. De resultaten van de studie, gepubliceerd in Science op 18 mei, laten zien dat het bestuderen van natuurlijke hartregeneratie in zebravissen en het toepassen van deze kennis op humane hartspiercellen kan bijdragen aan de ontwikkelingen van nieuwe therapieën tegen hart- en vaatziekten.
Naar schatting sterven jaarlijks 18 miljoen mensen aan hart- en vaatziekten. Veel van deze sterfgevallen zijn gerelateerd aan hartaanvallen. Tijdens zo’n aanval belemmert een bloedprop de toevoer van voedingsstoffen en zuurstof naar het hart. Hartspiercellen in het geblokkeerde deel van het hart gaan als gevolg hiervan dood, wat leidt tot hartfalen. Hoewel therapieën bestaan die symptomen bestrijden, is er een gebrek aan behandelingen die het verloren weefsel vervangen met functionele, volwassen cellen en daarmee patiënten kunnen genezen.
Zebravis als rolmodel
In tegenstelling tot mensen kunnen sommige dieren zoals zebravissen hun hart regenereren. Binnen 90 dagen na schade herstellen zij hun hartfunctie. Overlevende hartspiercellen slagen erin zich tijdens dit proces te delen en produceren zo nieuwe cellen. Dit unieke mechanisme is voor zebravissen een bron van nieuw weefsel om verloren hartspiercellen te vervangen. Eerdere studies hebben factoren geïdentificeerd die deze hartspierceldeling kunnen stimuleren. Wat er daarna gebeurt met de nieuwgevormde hartspiercellen is echter nog niet bestudeerd. Phong Nguyen, eerste auteur van de studie, legt uit: “Het is onduidelijk hoe deze cellen stoppen met delen en uitrijpen, zodat ze bij kunnen dragen aan normale hartfunctie. Het intrigeerde ons dat het nieuwe weefsel in het zebravis hart zonder problemen uitrijpte en in het bestaande hartweefsel integreerde.”
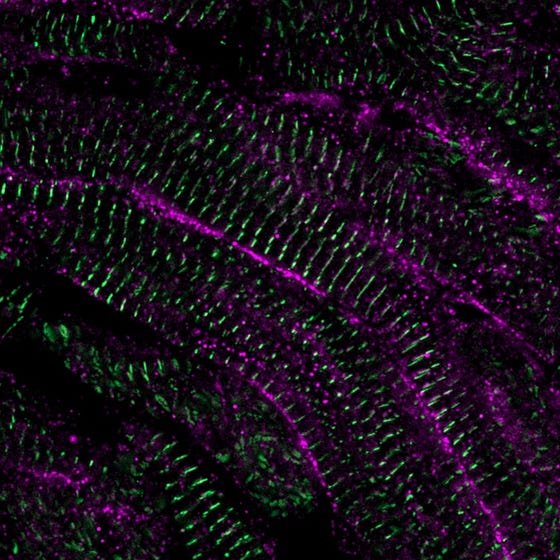
Gestructureerde, volwassen hartspiercellen in het zebravishart 60 dagen na schade. Credit: Phong Nguyen. Copyright: Hubrecht Institute.
LRRC10 stimuleert uitrijping
Om de uitrijping van het nieuwe weefsel in detail te bestuderen, ontwikkelden de onderzoekers een techniek waarbij dikke plakjes van beschadigde zebravisharten buiten het lichaam in kweek werden gebracht. Met behulp van genetische gecodeerde sensoreiwitten (GCaMP6f) is de dynamiek van calcium in de hartspiercellen live in beeld gebracht. De beweging van calcium in en uit hartspiercellen is belangrijk voor de samentrekking van het hart en is een graadmeter van hun uitrijping. Ze vonden dat, na deling, de snelheid waarmee calcium de hartspiercel in en uit ging veranderde. “De manier waarop calcium bewoog in de pas gedeelde cellen leek veel op de manier waarop dit in embryonale hartspiercellen gebeurt, maar over tijd vertoonden de cellen meer volwassen dynamiek van calcium. We ontdekten dat de dyad, een structuur die calcium reguleert in hartspiercellen, en één component in het bijzonder, genaamd LRRC10, bepaalde of hartspiercellen bleven delen of begonnen te rijpen. Hartspiercellen zonder LRRC10 bleven onrijp en bleven delen,” vertelt Nguyen.
Van vis naar mens
Nadat Nguyen en zijn collega’s het belang van LRRC10 voor celdeling en uitrijping in het zebravishart hadden vastgesteld, testten ze of hun vindingen ook vertaald konden worden naar zoogdieren zoals de mens. Hiervoor brachten ze LRRC10 tot expressie in gekweekte hartspiercellen van muizen en mensen. LRRC10 veranderde de calciumhuishouding, verminderde celdeling en bevorderde uitrijping van deze cellen op een vergelijkbare wijze als de onderzoekers zagen in zebravisharten. Nguyen: “Het was mooi om te zien dat de lessen die we geleerd hadden in de zebravis goed vertaald konden worden naar de mens. Dit biedt mogelijkheden voor het gebruik van LRRC10 in de context van nieuwe therapieën voor patiënten”.
Clinical impact
De resultaten van de studie, gepubliceerd in Science, laten zien dat LRRC10 door zijn rol in calciumhuishouding gebruikt kan worden om uitrijping van hartspiercellen te bevorderen. Dit zou wetenschappers kunnen helpen de schade aan het hart proberen te verbeteren door gekweekte hartspiercellen in het hart te transplanteren. Hoewel deze potentiële therapie veelbelovend is, laten resultaten zien dat de cellen nog onrijp zijn en niet kunnen communiceren met de rest van het orgaan. Dit leidt tot hartritmestoornissen na transplantatie. “Er is nog meer onderzoek nodig om precies te definiëren hoe volwassen gekweekte hartspiercellen zijn na behandeling met LRRC10, maar het is mogelijk dat een toename in uitrijping de integratie van getransplanteerde cellen bevordert,” vertelt Jeroen Bakkers, laatste auteur van de studie. Bakkers vervolgt: “Hiernaast zijn huidige modellen van hartziekten vaak gebaseerd op onrijpe gekweekte hartspiercellen. Dit zou mogelijk een oorzaak kunnen zijn waarom 90% van de veelbelovende medicijnen uiteindelijk de kliniek niet bereikt. Onze resultaten wijzen erop dat LRRC10 ook deze modellen kan verbeteren”. LRRC10 zou dus een belangrijke bijdrage kunnen leveren om hartspiercellen te kweken die meer lijken op hun evenknie in het volwassen mensenhart en daarmee de ontwikkeling van nieuwe succesvolle therapieën tegen hart- en vaatziekten te bevorderen.
Vervolgonderzoek met menselijke hartweefselplakjes
Het onderzoek naar calcium in de gekweekt plakjes zebravishart werd uitgevoerd in het lab van Teun de Boer (Medische Fysiologie, UMC Utrecht). Hier worden inmiddels ook plakjes menselijk hartweefsel, afkomstig van hartchirurgie, gekweekt voor onderzoek naar hartziekten. In deze plakjes wordt vervolgonderzoek gedaan naar LRRC10, maar ook naar andere factoren die een rol spelen bij ziekten van de hartspier. De Boer: “Het grote voordeel van de humane plakjes is dat ze erg representatief zijn voor de patiënt, en we kunnen ze in kweek langer dan tien dagen gezond houden. Als gevolg kunnen we veel van de technieken die we in de zebravis gebruikt hebben ook inzetten om humane ziekteprocessen te bestuderen.” De verwachting is dat de menselijke hartplakjes helpen om nog verder de brug te slaan tussen het lab en de kliniek.
Publicatie
Interplay between calcium and sarcomeres directs cardiomyocyte maturation during regeneration.
Phong D. Nguyen, Iris Gooijers, Giulia Campostrini, Arie O. Verkerk, Hessel Honkoop, Mara Bouwman, Dennis E. M. de Bakker, Tim Koopmans, Aryan Vink, Gerda E. M. Lamers, Avraham Shakked, Jonas Mars, Aat A. Mulder, Sonja Chocron, Kerstin Bartscherer, Eldad Tzahor, Christine L. Mummery, Teun P. de Boer, Milena Bellin, Jeroen Bakkers. Science, 2023.
De studie is het resultaat van een samenwerking tussen het Hubrecht Instituut, LUMC, AMC, UMC Utrecht en Weizmann Instituut. De studie is gefinancierd met behulp van de Hartstichting, DCVA en Stichting Hartekind.
--
Jeroen Bakkers is groepsleider bij het Hubrecht Institute en hoogleraar Moleculaire Cardiogenetica bij het UMC Utrecht
Teun de Boer is universitair hoofddocent bij de afdeling Medische Fysiologie, UMC Utrecht