Hoe herkennen immuuncellen kanker?
Een groot internationaal onderzoek van onder meer het UMC Utrecht heeft blootgelegd hoe kanker wordt herkend en opgeruimd door gamma delta T-cellen, een bepaald type witte bloedcellen. Dat geeft hoop voor de toekomst want hierdoor kunnen behandelingen effectiever worden gemaakt en beter worden gepersonaliseerd. De bevindingen van de studie zijn nu gepubliceerd in wetenschappelijk tijdschrift 'Nature'.
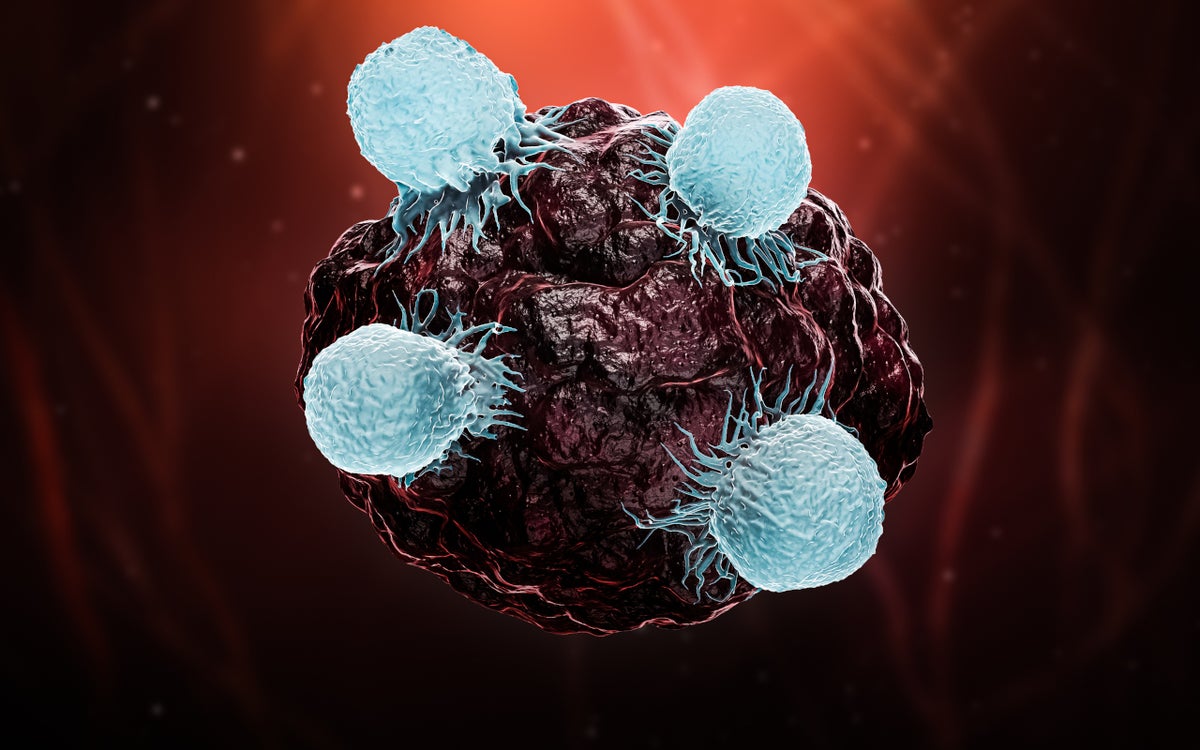
Virus, bacterie, kankercel of andere indringers: ons lichaam herkent ze en valt ze aan dankzij ons leger van T-cellen. Dat zijn een speciaal soort witte bloedcellen die in actie komen om het gevaar op te ruimen. Dit ingenieuze zelfverdedigingsmechanisme dient tegenwoordig als basis bij het ontwerpen van veel experimentele immunotherapieën.
Een bepaald type T-cel, de gamma delta T-cel, is een expert in juist het herkennen en aanpakken van kankercellen. Hoe dit type immuuncel daar precies in slaagt, was nog niet bekend. Dit nieuwe onderzoek maakt dat nu duidelijk, met behulp van CRISPR-technologie, organoïden en TEGs. Het UMC Utrecht werkte hiervoor samen met onder meer Gladstone Institutes en de Universiteit van Californië, San Francisco.
CRISPR, organoïden en TEGs?
Door middel van de zogeheten ‘CRISPR-techniek’ kan er heel specifiek in het DNA van cellen worden geknipt. Daardoor worden de genetische eigenschappen van die cellen gemanipuleerd. Dankzij CRISPR konden de onderzoekers duizenden genen in kankercellen verstoren om te bekijken welke aanpassingen er wel of niet toe leiden dat gamma delta T-cellen kankercellen aanvallen. Zo volgden ze stap voor stap op moleculair niveau hoe de immuuncellen hun werk doen.
Daarbij maakten ze gebruik van zogenoemde ‘organoïden’. Dit zijn driedimensionale mini-organen of mini-tumoren van ongeveer een millimeter groot, die in het laboratorium worden gemaakt uit stamcellen. Voor dit onderzoek werden borstkanker- en darmkankerorganoïden ingezet, die waren gekweekt in Utrecht.
Ook werden zogeheten ‘TEGs’ gebruikt: een volgende generatie van nieuwe ‘levende’ geneesmiddelen met genetisch bewerkte afweercellen, die in het UMC Utrecht worden ontwikkeld en getest bij patiënten.
Stress is de sleutel
Hoe weet een gamma delta T-cel (of een TEG) wanneer het ‘foute boel’ is en dat hij in actie moet komen? De onderzoekers zagen dat de gamma delta T-cellen een cel aan beginnen te vallen wanneer het butyrofilinegehalte in de cel explosief stijgt. Butyrofiline is een eiwit dat ook in gezonde cellen voorkomt. Maar bij gezonde cellen houden de gamma delta T-cellen zich nog koest. De immuuncellen komen pas in actie wanneer de hoeveelheid butyrofilinen zeer snel begint te stijgen, zoals het geval is in een kankercel.
Waardoor wordt die stijging van het butyrofilinegehalte precies veroorzaakt? De onderzoekers stelden vast dat de hoeveelheid butyrofilinen groeit, wanneer de cholesterolproductie in de kankercel toeneemt, oftewel wanneer de cel meer ‘stress’ ervaart. Zodra een kankercel begint te delen, komt deze typische stressreactie op gang. Vervolgens worden razendsnel meer butyrofilinen actief in de cel. Dat is hét signaal voor de gamma delta T-cellen dat ze de indringer, in dit geval de kankercel, aan moeten vallen.
Gerichter behandelen
Jürgen Kuball is hoogleraar hematologie aan het UMC Utrecht, en Zsolt Sebestyen is daar associate professor. Zij werkten met hun team mee aan dit onderzoek.
Sebestyen: “Met CRISPR haalden we juist die stukjes gen weg die invloed uitoefenen op de ‘stress pathways’ van de tumororganoïden. En toen zagen we inderdaad dat juist de stressreactie in een cel, via de gestegen hoeveelheid butyrofilinen, de sleutel is om gamma delta T-cellen te kunnen beïnvloeden.”
Deze studie is vernieuwend omdat wetenschappers daardoor nu op moleculair niveau weten hoe gamma delta T-cellen precies werken. Dat schept ontzettend veel mogelijkheden voor de toekomstige behandeling van kanker. Te denken valt aan therapieën die de hoeveelheid butyrofilinen beïnvloeden, waardoor de gamma delta T-cellen sneller in actie komen en effectiever kanker kunnen bestrijden.
Kuball: “Dit onderzoek is een bijzonder samenwerkingsverband tussen wetenschappers die fundamenteel (celgericht, red.) en klinisch-translationeel (patiëntgericht, red.) onderzoek doen. Met de resultaten kunnen artsen en onderzoekers immuuntherapie met gamma delta T-cellen gerichter personaliseren voor patiënten. Maar daarnaast kunnen we wellicht ook nieuwe levende geneesmiddelen, zoals TEGs, verder ontwikkelen door gebruik te maken van selectieve eigenschappen van gamma delta T-cellen.”